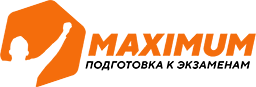Уравнение состояния?идеального газа?(уравнение?Менделеева-Клапейрона)?— формула, устанавливающая зависимость между давлением, объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
pV?=? ?, где
?, где
p?— давление [Па],
V?— объём [м3],
R?— универсальная газовая постоянная 8,31 [Дж/моль•К],
T?— абсолютная температура [K].
Количество вещества?— физическая величина, характеризующая количество атомов или молекул, содержащихся веществе. Единица измерения количества вещества —моль.
??=? ?, где
?, где
??? количество вещества [моль],
m?— масса [кг],
M?— молярная масса [кг/моль].
Изопроцессы?— термодинамические процессы, во время которых количество вещества и ещё одна из физических величин — параметров состояния: давление, объём или температура — остаются неизменными.
Изохорический?процесс?— термодинамический процесс, который происходит при постоянном объёме. Следовательно, объем?V?не изменяется, и значение давления прямолинейно зависит от температуры.
Для осуществления изохорного процесса в газе или жидкости достаточно нагревать (охлаждать) вещество в сосуде, который не изменяет своего объёма, например, в запаянном сосуде.
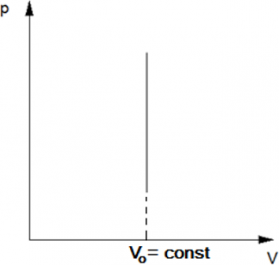
Изобарический?процесс?— термодинамический процесс, происходящий в системе при постоянном давлении и постоянной массе идеального газа. Следовательно, давление р не изменяется, и значение объёма прямолинейно зависит от температуры.
Простейшим примером изобарического процесса может служить нагревание воды в открытом сосуде.
Изотермический?процесс?— термодинамический процесс, происходящий в физической системе при постоянной температуре. Следовательно, температура?Т?не меняется, и значение давления обратно пропорционально объёму(гипербола).
p?=? ?=?
?=? ?.
?.
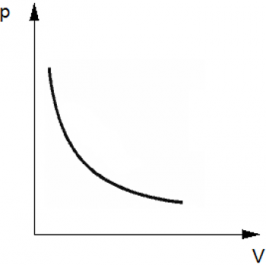
График имеет вид гиперболы, поскольку давление обратно пропорционально объему при постоянной температуре.
Рассмотрим две изотермы с одинаковой массой, но разной температурой на?pV?диаграмме (T1?<?T2).
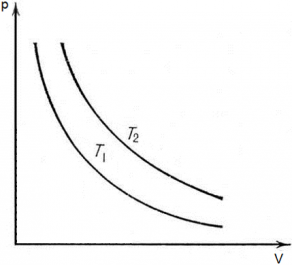
Изотерма с температурой?Т2?будет располагаться на диаграмме?pV?выше, чем изотерма с температурой?Т1, как следствие закона?pV?=?vRT. Так как при большем значение температуры значение коэффициента перед?V?в уравнении?p?=? ?будет больше (vRT2???vRT1), следовательно, гипербола будет выше.
?будет больше (vRT2???vRT1), следовательно, гипербола будет выше.
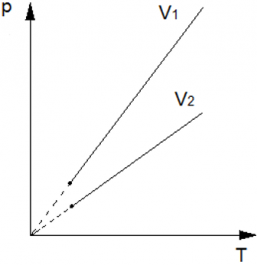
Теперь рассмотрим две изохоры одной массы, но разного объёма (V2?>?V1) на?pT?диаграмме. Изохора с?V1?будет выше?V2, аналогично, как следствие закона?pV?=?vRT. Так как при большем значении объема, коэффициент при?Т?будет меньше? ?, а следовательно и прямая на диаграмме?pT, будет ниже.
?, а следовательно и прямая на диаграмме?pT, будет ниже.