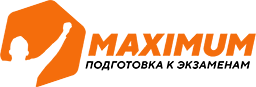Многие химические реакции, с которыми вы познакомились в течение курса осуществляют в промышленных условиях при производстве важнейшей для повседневной жизни химической продукции.
Пластмассы, синтетические волокна, фармацевтические препараты, удобрения, мыла и моющие средства, красители, пестициды, косметика и парфюмерные изделия и даже компоненты пищи - все это только некоторые виды продукции, выпуск которой полностью или частично зависит от химической промышленности. Одиннадцать первых мест по объему производства принадлежат следующим химическим веществам: Н2SO4, NH3, N2, СаО, О2, С2H4, NaOH, Сl2, HCl, HgPO4, HNO3. Эти-то вещества и используют я больших количествах далее для получения столь необходимых видов продукции, как названные выше.
Даже если речь идет о 100%-ном природном продукте, это означает лишь то, что в нем нет синтетических добавок, и совсем не означает, что при получении не использовали какие-либо химические технологии.
Химическая промышленность — это отрасль народного хозяйства, производящая продукцию на основе химической переработки сырья.
ВМС — это вещества с очень большой молекулярной массой, молекулы которых содержат повторяющиеся группировки атомов.
Способы получения полимеров: Неорганическая химия.
| Признак реакции | Классы реакций | Примеры |
| Изменение степени окисления | Окислительно-восстановительные | 2SO2 + O2 = 2SO3 |
| Неокислительно-восстановительные | KOH + HBr = KBr + H2O | |
| Характер процесса | Соединение | H2 + I2 = 2HI |
| Разложение | 2KClO3 = 2KCl + 3O2 | |
| Замещение | Ni + CuSO4 = Cu + NiSO4 | |
| Обмена | KOH + HCl = KCl + H2O | |
| Тепловой эффект | Экзотермический | С + O2 = CO2 + Q |
| Эндотермические | CaCO3 = CaO + CO2 – Q | |
| По агрегатному состоянию | Гомогенные | KOH + HCl = KCl + H2O (все вещества, в одном агрегатном состоянии) |
| Гетерогенные | 4FeS2(тв)+11O2(газ) = 2Fe2O3(тв) + 8SO2(газ) | |
| С V2 O5 катализатором или без | Каталитические | 2 SO2 + O2 = 2SO3 |
| Некаталитические | H2 + S=H2S |
Волокна — ВМС природного и синтетического происхождения, перерабатываемые в нити; характеризуются высокой упорядоченностью молекул.
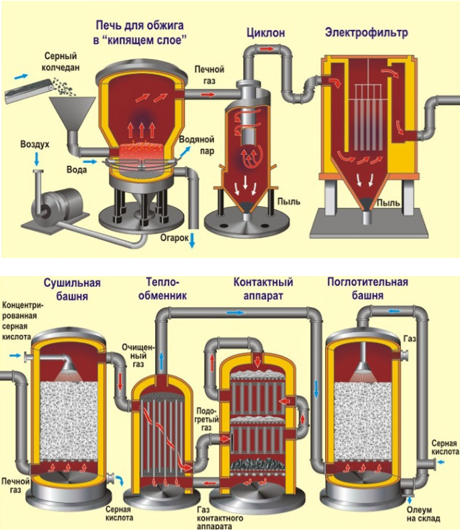
Производство серной кислоты
Схема процесса
Аппарат | Назначение | Реакция |
Печь для обжига «в кипящем слое» | Пирит подвергают обжигу кислородом воздуха | 4FeS2 + 11 O2 = 2Fe2O3 + 8SO2 + 3310 кДж |
Циклон |
Тщательная очистка от крупных частиц пыли |
- |
Электрофильтр | Тщательная очистка от мелких частиц пыли |
- |
Сушильная башня | Осушение от водяных паров | - |
Теплообменник | Очищенный обжиговый газ перед поступлением в контактный аппарат нагревают за счет теплоты газов, выходящих из контактного аппарата. | - |
Контактный аппарат | Обжиговый газ в присутствии катализатора при 450 °С окисляется до оксида серы (VI) | 2SО2 + О2 = 2SО3 +197,8 кДж |
Поглотительная башня | Оксид серы (VI) поглощают концентрированной серной кислотой. Образуется олеум, из которого можно приготовить серную кислоту любой концентрации. | SО3 + Н2О = Н2SО4 |
Производство аммиака
Схема процесса:
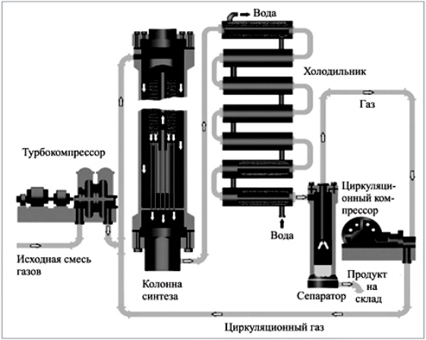
Рассмотрим реакцию, лежащую в основе получения целевого продукта:
N2 +3H2 = 2NH3 + 92 кДж
Подбор оптимальных условий проведения синтеза осуществляется исходя из характеристик химической реакции. (Используют все знания по химическому равновесию)
Реакция обратимая, гомогенная (исходные вещества и продукты — это газы) и идет с уменьшением объема, следовательно, смещению равновесия в сторону продуктов способствует повышенное давление.
Реакция экзотермическая, повышение температуры смещает химическое равновесие в сторону исходных веществ, а понижение температуры — в сторону продуктов реакции, но при этом скорость синтеза будет очень мала. Поэтому реакцию проводят при оптимальной для данного процесса температуре: 450–500 °С. Исходную смесь газов сначала нагревают в теплообменнике за счет движущихся противотоком выходящих газов, а затем в зоне экзотермической реакции. (Противоток — это движение различных веществ навстречу друг другу с целью создания наилучших условий для обмена энергией.)
Для ускорения синтеза, быстрейшего установления равновесия используют катализатор — восстановленное железо, активированное оксидами калия, алюминия и др. Реагенты и продукты реакции находятся в газовой фазе и образуют гомогенную систему. Реакция протекает на поверхности твердых катализаторов. Такая реакция составляет особый класс гетерогенно-каталитических реакций. Большое значение имеет площадь поверхности катализатора. Катализатор изготавливают в виде губчатых гранул или таблеток. Поскольку активность катализатора сильно снижается от присутствия примесей, то реагирующие газы подвергают тщательной очистке (от воды, соединений серы и др.).
При всех указанных условиях проведения реакции равновесный выход продукта составляет не более 20%. Поэтому синтез продукта осуществляется по способу многократной циркуляции, т. е. непрореагировавшую смесь газов многократно возвращают в производство после отделения от нее полученного продукта.